Причины изменения окраски индикаторов
Кислотно-основные индикаторы – индикаторы реагирующие на изменение рН раствора. К таким индикаторам относятся фенолфталеин, метиловый оранжевый, крезоловый синий, п-нитрофенол и др.
Существует несколько теорий кислотно-основных индикаторов. Основные из них: ионная теория, хромофорная теория, ионно-хромофорная теория.
Рассмотрим эти теории на примере п-нитрофенола:
Ионная теория:
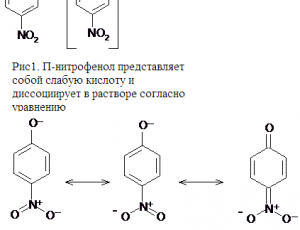
П-нитрофенол представляет собой слабую кислоту и диссоциирует в растворе согласно рисунку 1.
Окраска раствора в котором индикатор находится в молекулярной форме (в данном случае бесцветная) отличается от окраски индикатора в ионной форме (желтая окраска, интервал перехода 5,6 – 7,6 рН)
В кислой среде концентрация ионов водорода большая и равновесие сдвинуто влево, следовательно цвет индикатора – бесцветный. В нейтральной среде и при переходе к щелочной среде равновесие сдвигается вправо, так как концентрация ионов водорода уменьшается.
Зависимость от рН раствора определяется константой равновесия процесса диссоциации индикатора и называется константой индикатора, Кинд.
Для п-нитрофенола Кинд = [H+]*[[C6H4(NO2)O]-]/ [C6H4(NO2)OH]
Согласно хромофорной теории в процессе изменения рН раствора меняется строение молекулы п-нитрофенола, то есть происходит бензоидно-хиноидная таутомерия.
Обе формулы представляют одно соединение, но в различных таутомерных формах, в фенольной форме — бесцветная окраска, под действием щелочи происходит перегруппировка п-нитрофенола в аци-нитроциклогексадиенон и образуется хиноидная форма, которая имеет окраску.
Ваш ©Бот Квиринус




 (8 оценок, рейтинг: 4,88 из 5)
(8 оценок, рейтинг: 4,88 из 5)








ОСТАВИТЬ КОММЕНТАРИЙ